ارزیابی بیولوژیک ابزار پزشکی در آزمون زیست سازگاری | Biological Evaluation
روز های رویکرد “Check Box” جهت تایید زیست سازگاری (biocompatibility) کالای تولیدی، کالای وارداتی و کالای صادراتی به پایان رسیده است و تولیدکنندگان ابزار های پزشکی (medical devices) پیچیده امروزی باید آزمون زیست سازگاری (biocompatibility) خاص محصول پزشکی و مواد ناشی از فرآیند تولید را با اتخاذ رویکردی مبتنی بر ریسک جهت ارزیابی ایمنی بیولوژیکی انجام دهند.
مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، با داشتن نیروهای متخصص آمادگی کامل جهت انجام کلیه تستهای زیست سازگاری (biocompatibility tests) جهت رفع الزامات مراجع قانونی نظیر سازمان ملی استاندارد، سازمان غذا و دارو، اداره کل تجهیزات پزشکی، سازمان دامپزشکی، وزارت جهاد کشاورزی، موسسه تحقیقات ثبت و گواهی بذر و نهال و سایر مراکز قانونی دارد.
#آزمایشگاه همکار سازمان ملی استاندارد #آزمایشگاه همکار سازمان غذا و دارو #آزمایشگاه همکار اداره کل تجهیزات پزشکی #آزمایشگاه سنجش و پایش کیاژن فارما # آزمایشگاه کیاژن فارما #آزمایشگاه کنترل کیفی کیاژن فارما #تعرفه آزمون های زیست سازگاری #قیمت آزمون های زیست سازگاری #قیمت آزمون های سم شناسی #تعرفه آزمون های سم شناسی #آزمون های کالای وارداتی #آزمون های کالای صادراتی #آزمون های تولیدات دارویی #همکار شرکت های دارویی #Kiagenpharma# Kiagen# اصلاح و نباتات #آزمون های تخصصی گمرکی #آزمون های گمرکی #hvcdhfd hdlkd fd,g,Cd; #hvl,k cdsj shc’hvd #sl akhsd #sldj #Hcl,k sl akhsd #jsj sl akhsd #jsj ihd sl akhsd #Hcl,k ihd sl akhsd #Hcl,kihd sl akhsd #jsjihd sl akhsd
الزامات ارزیابی ایمنی بیولوژیک ابزار های پزشکی در تستهای زیست سازگاری چیست؟!
مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، فرآیند ارزیابی ایمنی بیولوژیک ابزارهای پزشکی را در سه مرحله مجزا در نظر می گیرد که شامل موارد زیر می باشد:
مرحله ۱: طرح ارزیابی ریسک محصول پزشکی| (BEP) Biological Evaluation Plan
طرح ارزیابی بیولوژیک (BEP)، یک ارزیابی اولیه خطر است و هدف آن برآورده کردن اهدافی است که در استاندارد ISO 10993-1، بند 4 “اصول کلی اعمال شده در ارزیابی بیولوژیک ابزار های پزشکی (medical devices)” ارائه شده است.
بخش اول این بند به طور مشخص بیان می کند که “ارزیابی ایمنی بیولوژیک (biological evaluation) باید توسط متخصصان آگاه و با تجربه برنامه ریزی، انجام و مستند شود”. در طرح ارزیابی بیولوژیک، مواد تشکیل دهنده ابزارهای پزشکی (medical devices)، مواد ناشی از پروسه تولید و تاریخچه استفاده از محصول پزشکی یا محصولات پزشکی مشابه مورد بررسی قرار خواهد گرفت. مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، با یک طرح ارزیابی بیولوژیک دقیق و جامع، تستهای زیست سازگاری (biocompatibility tests) ضروری و ریسک خطرات اولیه ابزار های پزشکی (medical devices) را مشخص خواهد کرد.
مرحله ۲: انجام آزمون ارزیابی ایمنی بیولوژیک بر روی ابزار پزشکی | Testing
در مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، تستهای زیست سازگاری (biocompatibility tests) و ارزیابی خطر (risk assessment)، بر اساس طرح ارزیابی بیولوژیک انجام خواهد شد که شامل تستهای زیست سازگاری درون تنی (in vivo tests)، تستهای زیست سازگاری برون تنی (in vitro tests)، آزمون های شیمی (chemical tests)، آزمون های فیزیکی (physical tests)، آزمون های میکروبی (microbial tests) و آزمون های مولکولی (molecular tests) می باشد.
مرحله ۳: گزارش ارزیابی بیولوژیک ابزار های پزشکی | Biological Evaluation Report (BEP)
در مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، گزارش ارزیابی بیولوژیک (BER)، جهت برآوردن الزامات مندرج در بند 7 استاندارد ISO 10993-1، ارائه خواهد شد و کارشناسان خبره و آموزش دیده کیاژن فارما موارد زیر را شناسایی و مستند خواهند کرد:
- استراتژی و محتوای برنامه ریزی شده برای ارزیابی بیولوژیک محصول پزشکی (medical devices)
- معیارهای تعیین مقبولیت ابزار پزشکی برای هدف مورد نظر و در راستای برنامه مدیریت ریسک
- کیفیت ویژگی های ابزارهای پزشکی
- دلیل انتخاب و یا چشم پوشی از آزمون زیست سازگاری (biocompatibility tests)
- تفسیر داده های موجود و نتایج آزمون زیست سازگاری
- هر گونه داده اضافی جهت تکمیل ارزیابی ایمنی بیولوژیک محصول پزشکی
- نتیجه گیری کلی ارزیابی بیولوژیک ابزار پزشکی
#آزمایشگاه همکار سازمان ملی استاندارد #آزمایشگاه همکار سازمان غذا و دارو #آزمایشگاه همکار اداره کل تجهیزات پزشکی #آزمایشگاه سنجش و پایش کیاژن فارما # آزمایشگاه کیاژن فارما #آزمایشگاه کنترل کیفی کیاژن فارما #تعرفه آزمون های زیست سازگاری #قیمت آزمون های زیست سازگاری #قیمت آزمون های سم شناسی #تعرفه آزمون های سم شناسی #آزمون های کالای وارداتی #آزمون های کالای صادراتی #آزمون های تولیدات دارویی #همکار شرکت های دارویی #Kiagenpharma# Kiagen# اصلاح و نباتات #آزمون های تخصصی گمرکی #آزمون های گمرکی #hvcdhfd hdlkd fd,g,Cd; #hvl,k cdsj shc’hvd #sl akhsd #sldj #Hcl,k sl akhsd #jsj sl akhsd #jsj ihd sl akhsd #Hcl,k ihd sl akhsd #Hcl,kihd sl akhsd #jsjihd sl akhsd
آزمون زیست سازگاری جهت ارزیابی بیولوژیک محصول پزشکی
آزمون زیست سازگاری | ارزیابی ایمنی بیولوژیک محصول پزشکی
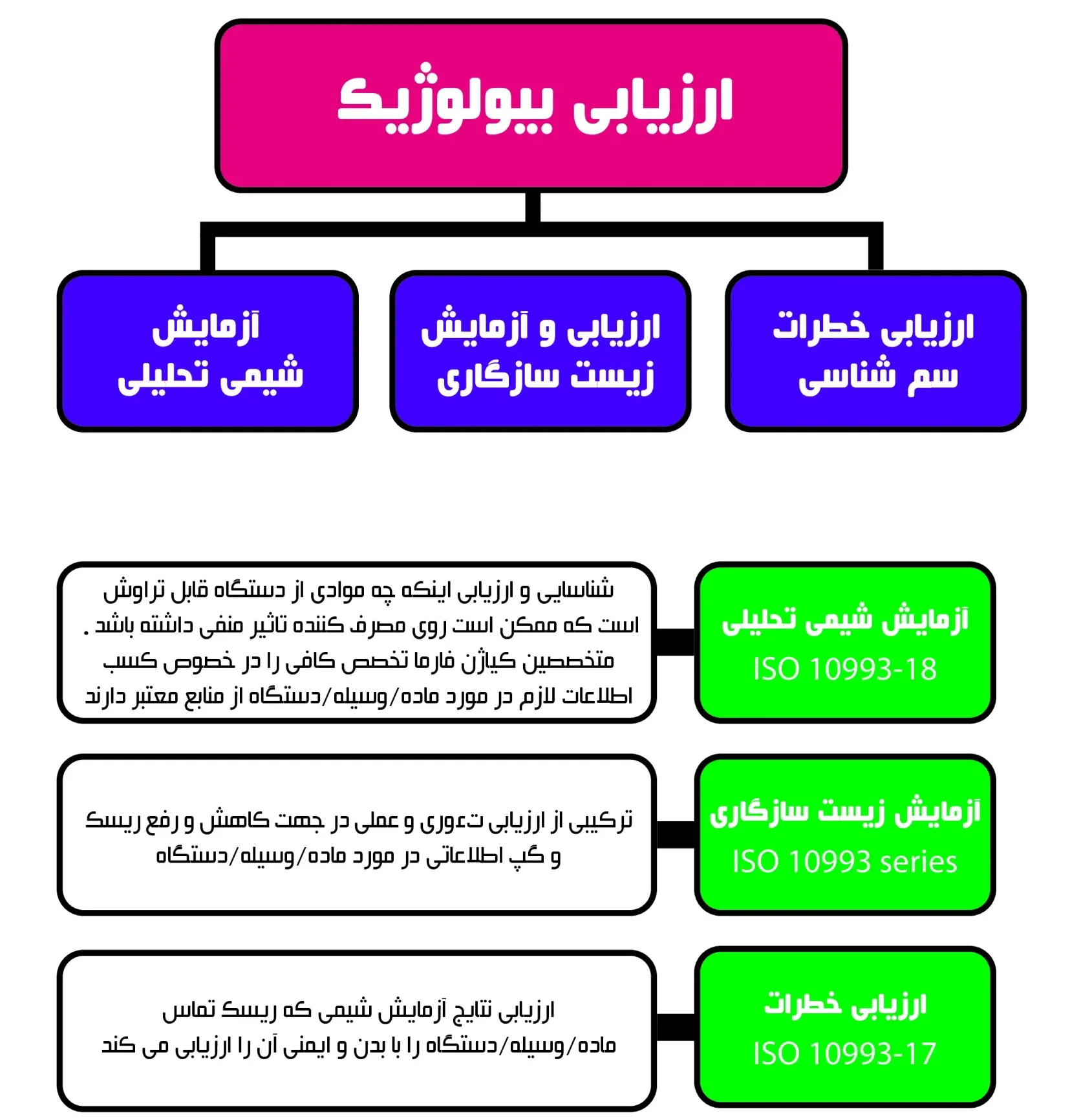
تستهای زیست سازگاری لازم جهت ارزیابی ایمنی بیولوژیک محصول پزشکی چیست؟!
در مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، جهت ارزیابی بیولوژیک ابزار های پزشکی، تستهای زیست سازگاری (biocompatibility tests) به صورت مرحله ای انجام خواهند شد و جهت رعایت اصول اخلاقی کار با حیوانات آزمایشگاهی (ethics)، رعایت ترتیب و اولویت تستهای زیست سازگاری برون تنی (in vitro tests) نسبت به تستهای زیست سازگاری درون تنی (in vivo tests) و همچنین پایبندی به اصول سه گانه (3R) در اجرای آزمون زیست سازگاری درون تنی از الزامات کیاژن فارما است که به ترتیب زیر می باشد:
بازنگری اطلاعات و یافته های در ارتباط با محصول پزشکی
در مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، ارزیابی خصوصیات فیزیکی و شیمیایی و همچنین کسب اطلاعات در مورد ساختمان مواد تشکیل دهنده ابزار های پزشکی و در صورت عدم دسترسی، ارزیابی موادیکه که از نظر ساختمانی با مواد تشکیل دهنده محصول پزشکی مورد نظر شباهت دارند، بسیار مهم می باشد. همچنین قبل از انجام آزمون زیست سازگاری (biocompatibility tests)، pH و PKA (قدرت اسیدی) عصاره ابزارهای پزشکی حتما اندازه گیری خواهد شد.
آزمون های برون تنی / آزمایشگاهی جهت ارزیابی ایمنی بیولوژیک محصول پزشکی چیست؟! | In vitro Studies
امروزه به جهت الزامات اخلاق کار با حیوانات آزمایشگاهی، تستهای زیست سازگاری (biocompatibility tests) تا جای ممکن در شرایط آزمایشگاهی انجام می شود، با این حال صنایع هنوز به شدت به آزمون های درون تنی متکی است و استفاده از آزمون زیست سازگاری برون تنی جایگزین آزمون زیست سازگاری درون تنی جهت ارزیابی بیولوژیک ابزار های پزشکی به طور قابل توجهی کند پیش می رود. این تاخیر را می توان به عدم وجود فرآیندهای اعتبار سنجی خاص و متناسب با محصول پزشکی و همچنین تردید در نتایج این آزمون ها نسبت داد.
در مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، به دلیل رعایت اصول سه گانه (3R)، آزمون های برون تنی نسبت به آزمون های درون تنی ارجعیت دارند بطوریکه در بخش تحقیق و توسعه آزمایشگاه (R&D)، کارشناسان ما در حال تحقیق و توسعه جهت راه اندازی و صحه گذاری (validation) تستهای زیست سازگاری معتبر برون تنی جهت جایگزینی با تستهای زیست سازگاری درون تنی / حیوانی هستند.
آزمون های درون تنی / حیوانی جهت ارزیابی ایمنی بیولوژیک محصول پزشکی چیست؟! |In vivo Studies
امروزه تلاش زیادی در جهت ارائه روشهای جایگزین به صورت برون تنی (in vitro)، خصوصا جهت ارزیابی تحریک زایی، حساسیت زایی و سمیت محصول پزشکی شده است و با وجود چالشهای فراوان در اتخاذ روشهای نوآورانه، گرایش به سمت پذیرش روش های جایگزین همچنان قوی است.
این روند توسط پیشرفت های تکنولوژیکی و ملاحظات اخلاقی، رو به رشد است و همه این موارد به طور جمعی به شناسایی ابزار های پزشکی ایمنتر و مؤثرتر کمک میکنند، بدین منظور و در راستای رعایت اصول سه گانه (3R)، مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، جهت ارزیابی حساسیت زایی پوستی، اقدام به راه اندازی روش آزمون جدیدتر و ایمن تر سنجش غدد لمفاوی موش (LLNA) و جایگزینی آن با روش های قدیمی تر بیشینه سازی در خوکچه هندی (GPMT) و پچ بسته (Closed Patch / Buehler) کرده است.
در مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، آزمون های درون تنی جهت ارزیابی ایمنی بیولوژیک ابزار های پزشکی انجام می شوند که بر اساس مطالعات قبلی، در دسته تحریک زای شدید (severe irritants) طبقه بندی نشده اند. در بخش حیوانی کیاژن فارما، جهت انجام آزمون زیست سازگاری درون تنی، اصول سه گانه (3R) و سلسله مراتب آزمون ها از لحاظ خطرات بر روی حیوانات آزمایشگاهی به دقت رعایت می شود، برای مثال تا آزمون تحریک زایی پوستی (dermal irritation test) انجام نشود، آزمون تحریک زایی چشمی (eye irritation test) هرگز انجام نخواهد شد.
آزمون های غیر تهاجمی انسانی / کارآزمایی بالینی جهت ارزیابی ایمنی بیولوژیک محصول پزشکی چیست؟!| Non Invasive Human Tests / Clinical Trials
کارآزمایی بالینی، مرحله پایانی ارزیابی ایمنی بیولوژیک ابزار پزشکی است که بر روی جمعیتهای انسانی انجام میشود تا اثرات محصول پزشکی بر روی مصرف کننده نهایی (انسان) مشخص شود.
#آزمایشگاه همکار سازمان ملی استاندارد #آزمایشگاه همکار سازمان غذا و دارو #آزمایشگاه همکار اداره کل تجهیزات پزشکی #آزمایشگاه سنجش و پایش کیاژن فارما # آزمایشگاه کیاژن فارما #آزمایشگاه کنترل کیفی کیاژن فارما #تعرفه آزمون های زیست سازگاری #قیمت آزمون های زیست سازگاری #قیمت آزمون های سم شناسی #تعرفه آزمون های سم شناسی #آزمون های کالای وارداتی #آزمون های کالای صادراتی #آزمون های تولیدات دارویی #همکار شرکت های دارویی #Kiagenpharma# Kiagen# اصلاح و نباتات #آزمون های تخصصی گمرکی #آزمون های گمرکی #hvcdhfd hdlkd fd,g,Cd; #hvl,k cdsj shc’hvd #sl akhsd #sldj #Hcl,k sl akhsd #jsj sl akhsd #jsj ihd sl akhsd #Hcl,k ihd sl akhsd #Hcl,kihd sl akhsd #jsjihd sl akhsd
استاندارد های زیست سازگاری | References
ISO 10993-2: Biological Evaluation of Medical Devices – Animal welfare requirements.
ISO 10993-5: Biological Evaluation of Medical Devices – Tests for in vitro cytotoxicity.
ISO 10993-6: Biological Evaluation of Medical Devices – Tests for local effects after implantation.
ISO 10993-7: Biological Evaluation of Medical Devices – Ethylene oxide sterilization residuals.
ISO 10993-10: Biological Evaluation of Medical Devices – Tests for skin sensitization.
ISO 10993-11: Biological Evaluation of Medical Devices – Tests for systemic toxicity.
ISO 10993-12: Biological Evaluation of Medical Devices – Sample preparation and reference materials.
ISO 10993-22: Biological Evaluation of Medical Devices – Guidance on nanomaterials.
ISO 10993-23: Biological Evaluation of Medical Devices – Tests for irritation.
OECD Test No. 401: Guidelines for the Testing of Chemicals – Acute Oral Toxicity.
OECD Test No. 402: Guidelines for the Testing of Chemicals – Acute Dermal Toxicity.
OECD Test No. 403: Guidelines for the Testing of Chemicals – Acute Inhalation Toxicity.
OECD Test No. 404: Guidelines for the Testing of Chemicals – Acute Dermal Irritation/Corrosion.
OECD Test No. 405: Guidelines for the Testing of Chemicals – Acute Eye Irritation/Corrosion.
OECD Test No. 406: Guidelines for the Testing of Chemicals – Skin Sensitisation.
OECD Test No. 414: Guidelines for the Testing of Chemicals – Prenatal Developmental Toxicity Study.
OECD Test No. 416: Guidelines for the Testing of Chemicals – Two-Generation Reproduction Toxicity.
OECD Test No. 417: Guidelines for the Testing of Chemicals – Toxicokinetics.
OECD Test No. 424: Guidelines for the Testing of Chemicals – Neurotoxicity Study in Rodents.
OECD Test No. 426: Guidelines for the Testing of Chemicals – Developmental Neurotoxicity Study.
OECD Test No. 427: Guidelines for the Testing of Chemicals – Skin Absorption: In Vivo Method.
OECD Test No. 428: Guidelines for the Testing of Chemicals – Skin Absorption: In Vitro Method.
OECD Test No. 429: Guidelines for the Testing of Chemicals – Skin Sensitisation.
OECD Test No. 432: Guidelines for the Testing of Chemicals – In Vitro 3T3 NRU Phototoxicity Test.
OECD Test No. 440: Guidelines for the Testing of Chemicals – Uterotrophic Bioassay in Rodents.
OECD Test No. 441: Guidelines for the Testing of Chemicals – Hershberger Bioassay in Rats.
OECD Test No. 451: Guidelines for the Testing of Chemicals – Carcinogenicity Studies.
OECD Test No. 452: Guidelines for the Testing of Chemicals – Chronic Toxicity Studies.
OECD Test No. 456: Guidelines for the Testing of Chemicals – H295R Steroidogenesis Assay.
OECD Test No. 471: Guidelines for the Testing of Chemicals – Bacterial Reverse Mutation Test.
OECD Test No. 478: Guidelines for the Testing of Chemicals – Rodent Dominant Lethal Test.
OECD Test No. 484: Guidelines for the Testing of Chemicals – Genetic Toxicology: Mouse Spot Test.
OECD Test No. 489: Guidelines for the Testing of Chemicals – In Vivo Mammalian Alkaline Comet Assay.
#آزمایشگاه همکار سازمان ملی استاندارد #آزمایشگاه همکار سازمان غذا و دارو #آزمایشگاه همکار اداره کل تجهیزات پزشکی #آزمایشگاه سنجش و پایش کیاژن فارما # آزمایشگاه کیاژن فارما #آزمایشگاه کنترل کیفی کیاژن فارما #تعرفه آزمون های زیست سازگاری #قیمت آزمون های زیست سازگاری #قیمت آزمون های سم شناسی #تعرفه آزمون های سم شناسی #آزمون های کالای وارداتی #آزمون های کالای صادراتی #آزمون های تولیدات دارویی #همکار شرکت های دارویی #Kiagenpharma# Kiagen# اصلاح و نباتات #آزمون های تخصصی گمرکی #آزمون های گمرکی
مقالات مرتبط رو حتما ببینید
نظر شما برای ما با ارزشه
0 دیدگاه

