
آزمون سمیت سیستم عصبی حاد | Acute Neurotoxicity Test
تست سمیت حاد دستگاه عصبی | Acute Neurotoxicity
تست سمیت عصبی حاد با استفاده از يك مدل حیوانی مناسب جهت برآوردن الزامات زیست سازگاری و ارزیابی ریسک خطرات سمیت (toxicological risk assessment) تجهیزات و وسایل پزشکی (medical devices)، انواع دارو (pharmaceuticals)، سم و آفت کش (pesticides)، محصولات آرایشی و بهداشتی (cosmetics)، مواد شیمیایی صنعتی (chemicals) و محصولات مصرفی (consumer products) بکار می رود. تستهای سمیت دستگاه عصبی در صنایع داروسازی (pharmaceutical industry) و زیست فناوری (biotechnology) بسیار رایج است.
در مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، آزمون سمیت حاد دستگاه عصبی بر اساس استاندارد OECD-424 انجام می شود و هدف از آزمون، ارزیابی پتانسیل سمیت عصبی موادیکه احتمال تاثیر منفی آن بر سیستم عصبی انسان وجود دارد می باشد.
توضیحات محصول
#acute neurotoxicity tests#سمیت سیستم عصبی حاد#سمیت تحریک سیستم عصبی حاد#مسمومیت عصبی حاد#بیماری های سیستم عصبی حاد#بررسی سمیت عصبی حاد#اثرات سمیت عصبی حاد#علائم سمیت عصبی حاد#علایم سمیت عصبی حاد#مسمومیت دستگاه عصبی حاد#سمیت دستگاه عصبی حاد
آزمون سمیت سیستم عصبی حاد | Acute Neurotoxicity
هدف از آزمون سمیت سیستم عصبی حاد، ارزیابی پتانسیل سمیت سیستم عصبی حاد و محاسبه دوز متوسط کشنده (LD50 ) لوازم و تجهیزات پزشکی (medical device)، در بازه ۱۴ روزه پس از تجویر خوراکی تک دوز (single dose) ماده آزمایشی به حیوانات آزمایشگاهی است.
تست سمیت سیستم عصبی حاد، یک تخمینی کلی از ماهیت سمی محدوده وسیعی از محصولات پزشکی، دارو، آفت کش، سم و مواد شیمیایی و خوراکی را بر سیستم عصبی مشخص می کند و نتایج حاصل از آزمون، جهت تعیین دوز شروع سایر تستهای سمیت سیستم عصبی مانند تست سمیت سیستم عصبی تحت حاد، تست سمیت سیستم عصبی تحت مزمن و تست سمیت سیستم عصبی مزمن استفاده خواهد شد.
روش کار
در مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، آزمون سمیت سیستم عصبی بر روی موش آزمایشگاهی نژاد سوری (NMRI) و یا رت آزمایشگاهی انجام می شود. پیش از شروع کار ابتدا مطالعات نظری و گذشته نگر از نظر موارد زیر بر روی نمونه آزمایشی و یا محصولات مشابه انجام خواهد شد تا اطلاعات کلی در مورد سمیت ماده آزمایشی و دز شروع حاصل شود. کلیه موارد بر اساس مولفه ها و معیارهای اشاره شده در استاندارد ISO 10993-1، انتخاب و ارزیابی خواهند شد.
- برگه پرسشنامه پر شده توسط متقاضی در خصوص ویژگی های نمونه آزمایشی (intended use/device characteristics)
- فرآیند مدیریت ریسک مواد (risk management process)
- تحلیل ریسک (risk analysis)
- شناسایی خطرات بیولوژیک محصول (biological hazard identification)
- ارزیابی در معرض قرار گیری (exposure assessment)
- کنترل ریسک (risk control)
- اطلاعات پس از تولید (post-production information)
ارزیابی بیولوژیک مواد پیش از شروع تستهای درون تنی، یک فعالیت علمی و بسیار مهم است که جهت توجیه و برنامه ریزی صحیح جهت ارزیابی خطرات بیولوژیکی یک ماده / وسیله و همچنین جهت کسب اطلاعات ضروری برای رعایت اصول اخلاقی کار با حیوانات آزمایشی (اصول 3R) و انتخاب روش مناسب جهت آماده سازی آزمایه باید انجام شود. چنین مطالعاتی مشخص می کند که آیا داده های موجود، برای نشان دادن ایمنی بیولوژیکی ماده / وسیله / دستگاه پزشکی مورد نظر، بدون نیاز به انجام تست های درون بدنی، کافی است یا خیر؟!
اگر پس از ارزیابی تئوری، داده های سم شناسی حاکی از ایمن بودن مواجهه بالینی محصول پزشکی و امکان شروع آزمون های حیوانی باشد، بخش حیوانی کیاژن فارما اقدام به انجام تستهای درون تنی خواهد کرد.
#سمیت حاد سیستم عصبی#سمیت حاد دستگاه عصبی#سمیت حاد عصبی#سمیت عصبی حاد#sldj sdsjl uwfd phn#sldj uwfd phn#sldj nsj’hi uwfd phn#sldj phn uwfd#sldj phn sdsjl uwfd#sldj phn nsj’hi uwfd
تست درون تنی مقدماتی | Pilot Study
در بخش حیوانی مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، هدف از انجام تست درون بدنی مقدماتی، مشخص کردن دوز مناسب آزمونه جهت شروع تست درون بدنی اصلی است. هنگامیکه بر اساس بررسی نظری محصول پیش از شروع آزمون، اطلاعات کافی در مورد ماده آزمایشی وجود ندارد، یک آزمون درونتنی مقدماتی جهت یافتن دز شروع ماده آزمایشی با استفاده از تعداد حداقلی از حیوانات انجام می شود.
- ابتدا یک موش سوری ۶ تا ۸ هفته با میانگین وزن ۲۰ تا ۳۰ گرم جهت انجام تست داخل بدنی مقدماتی آماده خواهد شد.
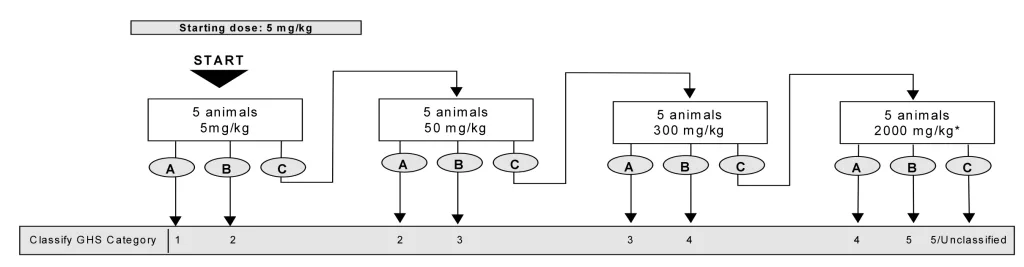
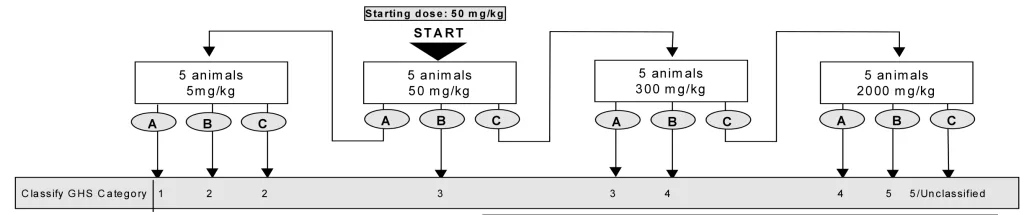
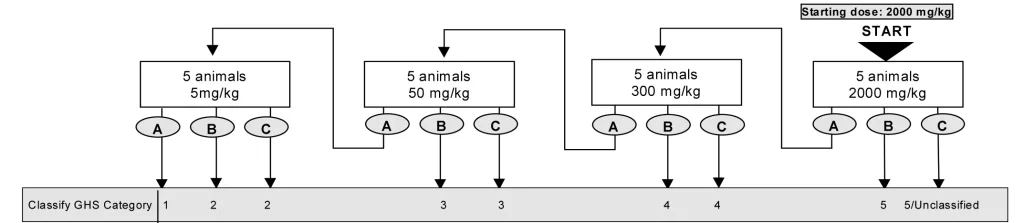
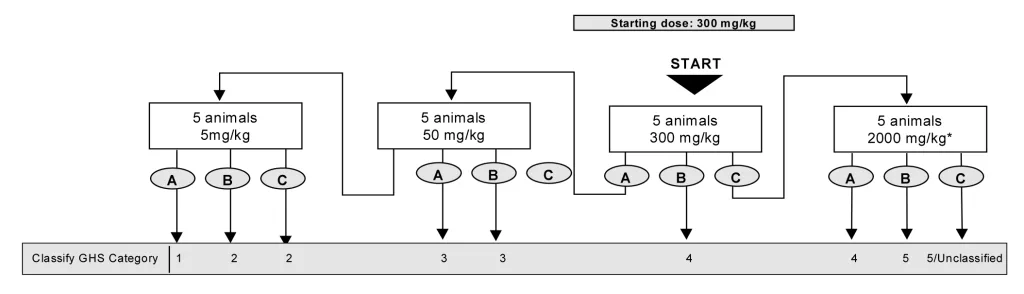
- حیوانات به صورت مرحله ای تحت تیمار با غلظت های ثابت ۵، ۵۰، ۳۰۰ و ۲۰۰۰ میلی گرم به ازای هر کیلوگرم وزن بدن حیوانات و بر اساس فلوچارت زیر قرار گرفته و از نظر علایم سمیت بررسی خواهند شد، سپس دوز مناسب آزمایه جهت دوز شروع آزمون حیوانی اصلی انتخاب خواهد شد.
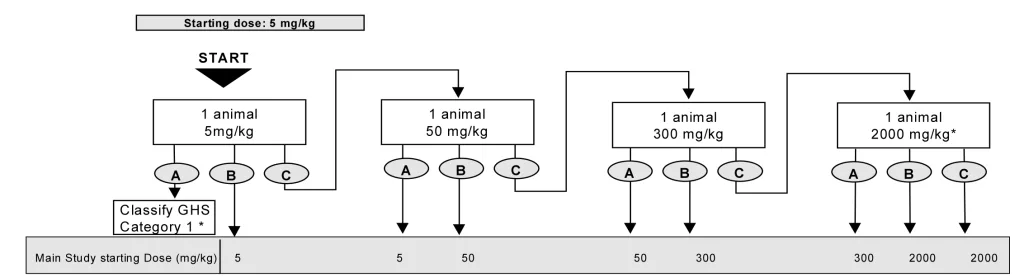
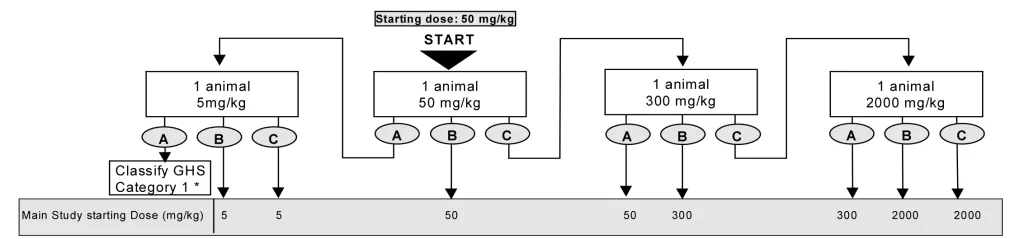
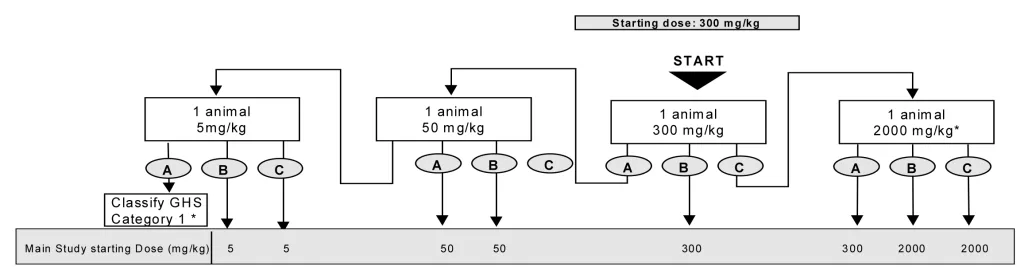
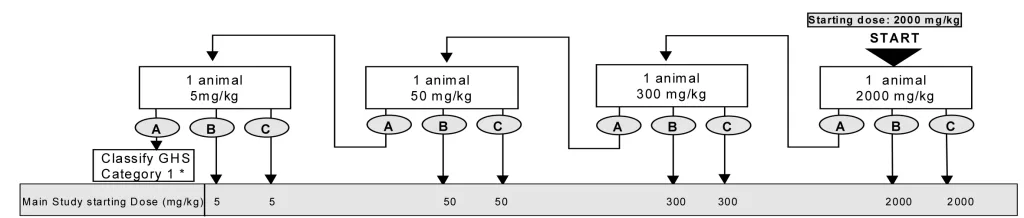
#acute neurotoxicity tests#سمیت سیستم عصبی حاد#سمیت تحریک سیستم عصبی حاد#مسمومیت عصبی حاد#بیماری های سیستم عصبی حاد#بررسی سمیت عصبی حاد#اثرات سمیت عصبی حاد#علائم سمیت عصبی حاد#علایم سمیت عصبی حاد#مسمومیت دستگاه عصبی حاد#سمیت دستگاه عصبی حاد
تست درون تنی اصلی | Main Study
در آزمون درون بدنی اصلی، حیوانات هر گروه پس از علامت گذاری، تحت تیمار با دوز های آزمونه قرار خواهد گرفت، بدین منظور تست بر اساس فلوچارت های زیر و به صورت مرحله ای تا رسیدن به هدف آزمون ادامه خواهد یافت.
#سمیت حاد سیستم عصبی#سمیت حاد دستگاه عصبی#سمیت حاد عصبی#سمیت عصبی حاد#sldj sdsjl uwfd phn#sldj uwfd phn#sldj nsj’hi uwfd phn#sldj phn uwfd#sldj phn sdsjl uwfd#sldj phn nsj’hi uwfd
#acute neurotoxicity tests#سمیت سیستم عصبی حاد#سمیت تحریک سیستم عصبی حاد#مسمومیت عصبی حاد#بیماری های سیستم عصبی حاد#بررسی سمیت عصبی حاد#اثرات سمیت عصبی حاد#علائم سمیت عصبی حاد#علایم سمیت عصبی حاد#مسمومیت دستگاه عصبی حاد#سمیت دستگاه عصبی حاد
در نهایت دز سمی نمونه آزمایشی و دسته GHS آن گزارش خواهد شد.
طول مدت مشاهدات حیوانات تحت آزمون، از زمان شروع تا پایان تست، حداقل به مدت ۱۴ روز است.
در پایان آزمون، کلیه حیوانات بر اساس موازین اخلاقی، معدوم و کالبدگشایی شده و اندام های داخلی بدن مورد ارزیابی دقیق ماکروسکوپی و میکروسکوپی (در صورت لزوم) قرار خواهند گرفت.
#acute neurotoxicity tests#سمیت سیستم عصبی حاد#سمیت تحریک سیستم عصبی حاد#مسمومیت عصبی حاد#بیماری های سیستم عصبی حاد#بررسی سمیت عصبی حاد#اثرات سمیت عصبی حاد#علائم سمیت عصبی حاد#علایم سمیت عصبی حاد#مسمومیت دستگاه عصبی حاد#سمیت دستگاه عصبی حاد#سمیت حاد سیستم عصبی#سمیت حاد دستگاه عصبی#سمیت حاد عصبی#سمیت عصبی حاد#sldj sdsjl uwfd phn#sldj uwfd phn#sldj nsj’hi uwfd phn#sldj phn uwfd#sldj phn sdsjl uwfd#sldj phn nsj’hi uwfd
آزمون تعیین حد | Limit Test
به طور استثناء زمانیکه الزامات قانونی مطرح باشد، از دوز های بالاتر از ۲۰۰۰ میلی گرم (۵۰۰۰ میلی گرم به ازای هر کیلوگرم وزن بدن) جهت تست تعیین حد استفاده خواهد شد. در بخش حیوانی مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، تنها در موارد زیر، به شرط اینکه در دوز ۲۰۰۰ میلی گرم، علایم سمیت مشاهده نشده باشد، تست حد انجام خواهد شد:
- شواهدی دال بر سمی بودن نمونه آزمایشی در دوز های بالاتر از حد مجاز (regulatory limit doses) وجود داشته باشد و برای جمعیت های آسیب پذیر خطرناک باشد.
- نمونه مورد آزمایش، تاثیر مستقیم بر سلامت انسان، حیوان و یا محیط زیست داشته باشد.
در مواردیکه اطلاعاتی از ماده مورد آزمایش موجود نیست و یا احتمال سمی بودن آن وجود دارد، نباید آزمون تعیین حد انجام شود.
#سمیت حاد سیستم عصبی#سمیت حاد دستگاه عصبی#سمیت حاد عصبی#سمیت عصبی حاد#sldj sdsjl uwfd phn#sldj uwfd phn#sldj nsj’hi uwfd phn#sldj phn uwfd#sldj phn sdsjl uwfd#sldj phn nsj’hi uwfd
استاندارد های زیست سازگاری | References
ISO 10993-2: Biological Evaluation of Medical Devices – Animal welfare requirements.
ISO 10993-5: Biological Evaluation of Medical Devices – Tests for in vitro cytotoxicity.
ISO 10993-6: Biological Evaluation of Medical Devices – Tests for local effects after implantation.
ISO 10993-7: Biological Evaluation of Medical Devices – Ethylene oxide sterilization residuals.
ISO 10993-10: Biological Evaluation of Medical Devices – Tests for skin sensitization.
ISO 10993-11: Biological Evaluation of Medical Devices – Tests for systemic toxicity.
ISO 10993-12: Biological Evaluation of Medical Devices – Sample preparation and reference materials.
ISO 10993-22: Biological Evaluation of Medical Devices – Guidance on nanomaterials.
ISO 10993-23: Biological Evaluation of Medical Devices – Tests for irritation.
OECD Test No. 401: Guidelines for the Testing of Chemicals – Acute Oral Toxicity.
OECD Test No. 402: Guidelines for the Testing of Chemicals – Acute Dermal Toxicity.
OECD Test No. 403: Guidelines for the Testing of Chemicals – Acute Inhalation Toxicity.
OECD Test No. 404: Guidelines for the Testing of Chemicals – Acute Dermal Irritation/Corrosion.
OECD Test No. 405: Guidelines for the Testing of Chemicals – Acute Eye Irritation/Corrosion.
OECD Test No. 406: Guidelines for the Testing of Chemicals – Skin Sensitisation.
OECD Test No. 414: Guidelines for the Testing of Chemicals – Prenatal Developmental Toxicity Study.
OECD Test No. 416: Guidelines for the Testing of Chemicals – Two-Generation Reproduction Toxicity.
OECD Test No. 417: Guidelines for the Testing of Chemicals – Toxicokinetics.
OECD Test No. 424: Guidelines for the Testing of Chemicals – Neurotoxicity Study in Rodents.
OECD Test No. 426: Guidelines for the Testing of Chemicals – Developmental Neurotoxicity Study.
OECD Test No. 427: Guidelines for the Testing of Chemicals – Skin Absorption: In Vivo Method.
OECD Test No. 428: Guidelines for the Testing of Chemicals – Skin Absorption: In Vitro Method.
OECD Test No. 429: Guidelines for the Testing of Chemicals – Skin Sensitisation.
OECD Test No. 432: Guidelines for the Testing of Chemicals – In Vitro 3T3 NRU Phototoxicity Test.
OECD Test No. 440: Guidelines for the Testing of Chemicals – Uterotrophic Bioassay in Rodents.
OECD Test No. 441: Guidelines for the Testing of Chemicals – Hershberger Bioassay in Rats.
OECD Test No. 451: Guidelines for the Testing of Chemicals – Carcinogenicity Studies.
OECD Test No. 452: Guidelines for the Testing of Chemicals – Chronic Toxicity Studies.
OECD Test No. 456: Guidelines for the Testing of Chemicals – H295R Steroidogenesis Assay.
OECD Test No. 471: Guidelines for the Testing of Chemicals – Bacterial Reverse Mutation Test.
OECD Test No. 478: Guidelines for the Testing of Chemicals – Rodent Dominant Lethal Test.
OECD Test No. 484: Guidelines for the Testing of Chemicals – Genetic Toxicology: Mouse Spot Test.
OECD Test No. 489: Guidelines for the Testing of Chemicals – In Vivo Mammalian Alkaline Comet Assay.









دیدگاهها
هیچ دیدگاهی برای این خدمت نوشته نشده است.