
آزمون واکنش بیولوژیک درون تنی | Biological Reactivity Test (in vivo)
آزمون واکنش بیولوژیک درون تنی | Biological Reactivity Test (in vivo)
در مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، تست واکنش بیولوژیک درون تنی جهت ارزیابی واکنش بیولوژیک بدن به لوازم و تجهیزات پزشکی (medical devices)، دارو (pharmaceuticals)، سم و آفت کش (pesticides)، محصولات آرایشی و بهداشتی (cosmetics)، مواد شیمیایی صنعتی (chemicals) و محصولات مصرفی انجام می شود.
تست واکنش بیولوژیک درون تنی جزء الزامات سازمان ملی استاندارد، سازمان غذا و دارو و اداره کل تجهیزات پزشکی می باشد.
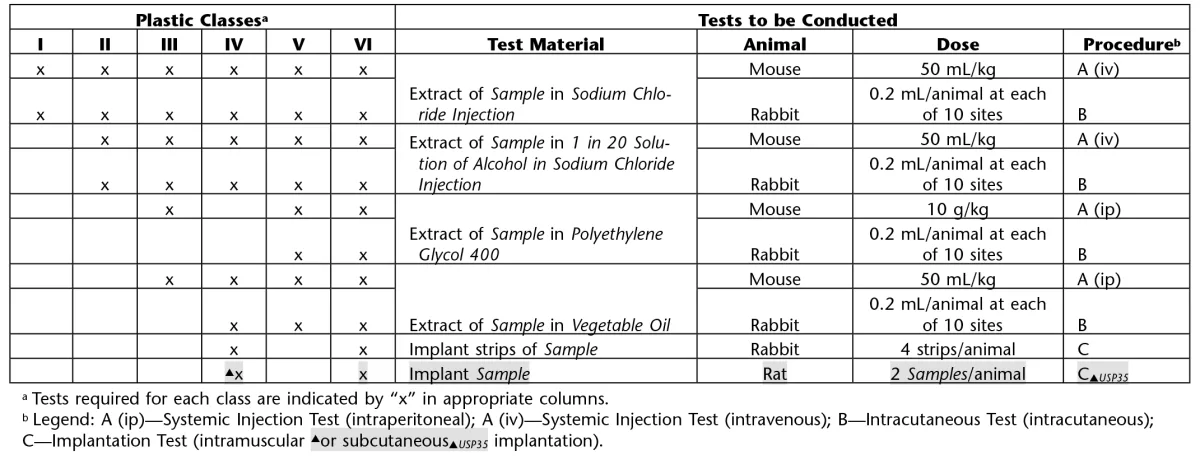
آزمایش بر اساس نوع ماده آزمایش و مواد تشکیل دهنده آن و هدف آزمون به 3 شکل زیر قابل انجام است:
- Systemic Injection Test
- Intracutaneous Test
- Implantation Test
- بطور کلی این 3 آزمایش برای وسایل و تجهیزات پزشکی به شکل پلاستیک، الاستومر و پلیمر کاربرد دارد. آزمایش تزریق سیستمیک و آزمایش تزریق داخل جلدی جهت مواد الاستومری و خصوصا آن هایی که آزمون واکنش بیولوژیک برون تنی آن ها مثبت شده است و آزمایش کاشت جهت مواد پلیمری و پلاستیک ها توصیه می شوند.
- تست تزریق سیستمیک جهت ارزیابی واکنش بیولوژیک سیستمیک بدن و تست تزریق داخل جلدی جهت ارزیابی واکنش بیولوژیک موضعی بدن با تزریق تک دوز عصاره نمونه و آزمایش کاشت جهت ارزیابی واکنش بیولوژیک بافت زنده از طریق کاشت نمونه در بدن انجام می شود.
- فاکتورهایی مثل ترکیبات مواد تشکیل دهنده و روش های پردازش و پاکسازی، مواد نگهدارنده، چسب و حتی شرایط نگهداری و دمایی ممکن است در نتایج تاثیرگذار باشد. بنابراین در برخی موارد ارزیابی چنین فاکتورهایی توسط آزمایش های تکمیلی نیاز است.
توضیحات محصول
تست واکنش بیولوژیک درون تنی | Biological Reactivity Test (in vivo)
تست واکنش بیولوژیک درون تنی جهت ارزیابی واکنش بیولوژیک بدن بدنبال تماس مستقیم یا غیر مستقیم با ماده و یا عصاره استخراج شده از مواد پلیمری، پلاستیک ها و الاستومرها انجام می شود.
آزمون به 3 شکل زیر قابل انجام است:
عصاره بر اساس نوع ماده آزمایش و حیوان انتخابی، در غلظت های مشخص و به یکی از اشکال زیر به حیوانات تزریق خواهد شد (جدول):
- Systemic Injection Test
- Intracutaneous Test
- Implantation Test
#تست واکنش بیولوژیک#سنجش واکنش بیولوژیک#biological reactivity test#تست biological reactivity#سنجش فعالیت بیولوژیک#تست فعالیت بیولوژیک#تست ارزیابی بیولوژیک#سنجش ارزیابی بیولوژیک#سنجش ارزیابی فعالیت بیولویک#sk[a ,h;ka fd,g,Cd;#تست ارزیابی فعالیت بیولوژیک
#تست واکنش بیولوژیک#سنجش واکنش بیولوژیک#biological reactivity test#تست biological reactivity#سنجش فعالیت بیولوژیک#تست فعالیت بیولوژیک#تست ارزیابی بیولوژیک#سنجش ارزیابی بیولوژیک#سنجش ارزیابی فعالیت بیولوژیک#sk[a ,h;ka fd,g,Cd;#تست ارزیابی فعالیت بیولوژیک
آزمون تزریق سیستمیک | Systemic Injection Test
آزمایش تزریق سیستمیک جهت ارزیابی واکنش بیولوژیک بدن به عصاره گرفته شده از نمونه آزمایش کاربرد دارد:
- در بخش حیوانی مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، معمولا از 5 سر موش سوری 17 تا 23 گرم جهت انجام آزمون استفاده می شود.
- عصاره استخراج شده از نمونه آزمایش به صورت داخل وریدی به تعداد مشخصی از حیوانات تزریق خواهد شد.
- حیوانات 4، 24، 48 و 72 ساعت بعد از تزریق از نظر علائم سرخی، ادم و نکروز بافتی بررسی خواهند شد (جدول).
- اگر پاسخ بیولوژیک هیچ یک از حیوانات گروه تیمار بیشتر از حیوانات گروه کنترل نبود، الزامات آزمون برآورده شده است.
- اگر رفتارهای غیرطبیعی مثل تشنج و حالت خمیدگی در 2 یا تعداد بیشتری از حیوانات مشاهده شد و یا اگر کاهش وزن بیش از 2 گرم در 3 یا تعداد بیشتری از حیوانات مشاهده شد، الزامات آزمون برآورده نشده است.
- اگر هریک از حیوانات علایم خفیف واکنش بیولوژیک را نشان دادند و یا یک حیوان علایم بارز واکنش بیولوژیک نشان داد و یا مرد، آزمون بر روی یک دسته 10 تایی از حیوانات تکرار خواهد شد و اگر در آزمون تکرار، کل 10 حیوان علایم بیولوژیک نشان ندادند، الزامات آزمون برآورده شده است.
#تست واکنش بیولوژیک#سنجش واکنش بیولوژیک#biological reactivity test#تست biological reactivity#سنجش فعالیت بیولوژیک#تست فعالیت بیولوژیک#تست ارزیابی بیولوژیک#سنجش ارزیابی بیولوژیک#سنجش ارزیابی فعالیت بیولوژیک#sk[a ,h;ka fd,g,Cd;#تست ارزیابی فعالیت بیولوژیک
آزمون تزریق داخل جلدی | Intracutaneous Test
آزمایش تزریق درون جلدی جهت ارزیابی واکنش بیولوژیک بدن به عصاره گرفته شده از نمونه آزمایش کاربرد دارد:
- در بخش حیوانی مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما، معمولا از 2 خرگوش آلبینوی آزمایشگاهی با پوست سالم جهت انجام آزمون استفاده می شود.
- عصاره استخراج شده از نمونه آزمایش و نمونه کنترل منفی (حلال) در سمت مقابل آن به صورت داخل جلدی به تعداد مشخصی از حیوانات تزریق خواهد شد.
- حیوانات 4، 24، 48 و 72 ساعت بعد از تزریق از نظر علائم سرخی، ادم و نکروز بافتی بررسی خواهند شد (جدول).
- اگر تفاوت میانگین امتیاز گروه تیمار از کنترل یک یا کمتر از یک شد الزامات آزمون برآورده شده است.
- اگر در هر دوره مشاهدات میانگین امتیاز گروه تیمار از کنترل بیشتر شد، آزمایش را بر روس 3 خرگوش دیگر تکرار خواهد شد و اگر در تکرار آزمون، تفاوت میانگین امتیاز گروه تیمار از کنترل یک یا کمتر از یک شد الزامات آزمون برآورده شده است.
#تست واکنش بیولوژیک#سنجش واکنش بیولوژیک#biological reactivity test#تست biological reactivity#سنجش فعالیت بیولوژیک#تست فعالیت بیولوژیک#تست ارزیابی بیولوژیک#سنجش ارزیابی بیولوژیک#سنجش ارزیابی فعالیت بیولوژیک#sk[a ,h;ka fd,g,Cd;#تست ارزیابی فعالیت بیولوژیک
| Score | Erythema and Eschar Formation |
|---|---|
| 0 | No erythema |
| 1 | Very slight erythema (barely perceptible) |
| 2 | Well-defined erythema |
| 3 | Moderate to severe erythema |
| 4 | Severe erythema (beet-redness) to slight eschar formation (injuries in depth) |
| Score | Edema Formation |
| 0 | No edema |
| 1 | Very slight edema (barely perceptible) |
| 2 | Slight edema (edges of area well defined by definite raising) |
| 3 | Moderate edema (raised approximately 1 mm) |
| 4 | Severe edema (raised more than 1 mm and extending beyond the area of exposure) |
#تست واکنش بیولوژیک#سنجش واکنش بیولوژیک#biological reactivity test#تست biological reactivity#سنجش فعالیت بیولوژیک#تست فعالیت بیولوژیک#تست ارزیابی بیولوژیک#سنجش ارزیابی بیولوژیک#سنجش ارزیابی فعالیت بیولوژیک#sk[a ,h;ka fd,g,Cd;#تست ارزیابی فعالیت بیولوژیک
آزمون کاشت | Implantation Test
آزمایش کاشت جهت ارزیابی واکنش بیولوژیک بدن به مواد پلاستیکی و پلیمری که در کاربری بالینی در تماس مستقیم با بافت بدن قرار دارند کاربرد دارد:
- در بخش حیوانی مجموعه آزمایشگاه های سنجش و پایش کیاژن فارما از رت آزمایشگاهی جهت کاشت نمونه در بافت زیرجلد و خرگوش آزمایشگاهی جهت کاشت نمونه در بافت عضلانی استفاده می شود.
کاشت داخل عضلانی در خرگوش
- جهت انجام آزمون، 8 نمونه آزمایش در بافت عضلانی 2 خرگوش آزمایشگاهی کاشت خواهد شد، بدین منظور 4 نمونه داخل بافت ماهیچه ای اطراف مهره ای (paravertebral muscle) یک طرف ستون فقرات و 2 نمونه کنترل داخل بافت ماهیچه ای طرف مقابل نمونه ایمپلنت خواهد شد.
- در پایان آزمون، مشاهدات ماکروسکوپی بر روی نواحی بافتی احاطه کننده بخش مرکزی نمونه ها انجام خواهد شد. مشاهدات شامل بررسی خونریزی، نکروز، تغییر رنگ، عفونت و بررسی کپسوله شدن و عمق آن (جدول) است.
- اگر تفاوت امتیاز میانگین گروه تیمار و کنترل، 1 یا کمتر از 1 شد، یا اگر تفاوت امتیاز بیش از 1 نمونه از 4 نمونه در هر حیوان از 1 بیشتر نشد، الزامات آزمون برآورده شده است.
کاشت داخل جلدی در موش صحرایی
- جهت انجام آزمون، 10 نمونه آزمایش و 10 نمونه استاندارد در بافت جلدی 5 رت آزمایشگاهی کاشت خواهد شد.
- در پایان آزمون، مشاهدات ماکروسکوپی بر روی نواحی بافتی احاطه کننده بخش مرکزی نمونه ها انجام خواهد شد. مشاهدات شامل بررسی خونریزی، نکروز، تغییر رنگ، عفونت و بررسی کپسوله شدن و عمق آن (جدول) است.
- اگر تفاوت امتیاز میانگین گروه تیمار و کنترل، 1 یا کمتر از 1 شد الزامات آزمون برآورده شده است.
#تست واکنش بیولوژیک#سنجش واکنش بیولوژیک#biological reactivity test#تست biological reactivity#سنجش فعالیت بیولوژیک#تست فعالیت بیولوژیک#تست ارزیابی بیولوژیک#سنجش ارزیابی بیولوژیک#سنجش ارزیابی فعالیت بیولوژیک#sk[a ,h;ka fd,g,Cd;#تست ارزیابی فعالیت بیولوژیک
| Score | Capsule Width |
|---|---|
| 0 | None |
| 1 | Up to 0.5 mm |
| 2 | 0.6-1.0 mm |
| 3 | 1.1–2.0 mm |
| 4 | Greater than 2.0 mm |
#تست واکنش بیولوژیک#سنجش واکنش بیولوژیک#biological reactivity test#تست biological reactivity#سنجش فعالیت بیولوژیک#تست فعالیت بیولوژیک#تست ارزیابی بیولوژیک#سنجش ارزیابی بیولوژیک#سنجش ارزیابی فعالیت بیولوژیک#sk[a ,h;ka fd,g,Cd;#تست ارزیابی فعالیت بیولوژیک
استاندارد های زیست سازگاری | References
ISO 10993-2: Biological Evaluation of Medical Devices – Animal welfare requirements.
ISO 10993-5: Biological Evaluation of Medical Devices – Tests for in vitro cytotoxicity.
ISO 10993-6: Biological Evaluation of Medical Devices – Tests for local effects after implantation.
ISO 10993-7: Biological Evaluation of Medical Devices – Ethylene oxide sterilization residuals.
ISO 10993-10: Biological Evaluation of Medical Devices – Tests for skin sensitization.
ISO 10993-11: Biological Evaluation of Medical Devices – Tests for systemic toxicity.
ISO 10993-12: Biological Evaluation of Medical Devices – Sample preparation and reference materials.
ISO 10993-22: Biological Evaluation of Medical Devices – Guidance on nanomaterials.
ISO 10993-23: Biological Evaluation of Medical Devices – Tests for irritation.
OECD Test No. 401: Guidelines for the Testing of Chemicals – Acute Oral Toxicity.
OECD Test No. 402: Guidelines for the Testing of Chemicals – Acute Dermal Toxicity.
OECD Test No. 403: Guidelines for the Testing of Chemicals – Acute Inhalation Toxicity.
OECD Test No. 404: Guidelines for the Testing of Chemicals – Acute Dermal Irritation/Corrosion.
OECD Test No. 405: Guidelines for the Testing of Chemicals – Acute Eye Irritation/Corrosion.
OECD Test No. 406: Guidelines for the Testing of Chemicals – Skin Sensitisation.
OECD Test No. 414: Guidelines for the Testing of Chemicals – Prenatal Developmental Toxicity Study.
OECD Test No. 416: Guidelines for the Testing of Chemicals – Two-Generation Reproduction Toxicity.
OECD Test No. 417: Guidelines for the Testing of Chemicals – Toxicokinetics.
OECD Test No. 424: Guidelines for the Testing of Chemicals – Neurotoxicity Study in Rodents.
OECD Test No. 426: Guidelines for the Testing of Chemicals – Developmental Neurotoxicity Study.
OECD Test No. 427: Guidelines for the Testing of Chemicals – Skin Absorption: In Vivo Method.
OECD Test No. 428: Guidelines for the Testing of Chemicals – Skin Absorption: In Vitro Method.
OECD Test No. 429: Guidelines for the Testing of Chemicals – Skin Sensitisation.
OECD Test No. 432: Guidelines for the Testing of Chemicals – In Vitro 3T3 NRU Phototoxicity Test.
OECD Test No. 440: Guidelines for the Testing of Chemicals – Uterotrophic Bioassay in Rodents.
OECD Test No. 441: Guidelines for the Testing of Chemicals – Hershberger Bioassay in Rats.
OECD Test No. 451: Guidelines for the Testing of Chemicals – Carcinogenicity Studies.
OECD Test No. 452: Guidelines for the Testing of Chemicals – Chronic Toxicity Studies.
OECD Test No. 456: Guidelines for the Testing of Chemicals – H295R Steroidogenesis Assay.
OECD Test No. 471: Guidelines for the Testing of Chemicals – Bacterial Reverse Mutation Test.
OECD Test No. 478: Guidelines for the Testing of Chemicals – Rodent Dominant Lethal Test.
OECD Test No. 484: Guidelines for the Testing of Chemicals – Genetic Toxicology: Mouse Spot Test.
OECD Test No. 489: Guidelines for the Testing of Chemicals – In Vivo Mammalian Alkaline Comet Assay.









دیدگاهها
هیچ دیدگاهی برای این خدمت نوشته نشده است.